En este objeto de aprendizaje se presenta información relacionada con las partículas subatómicas, sus características y localización en el átomo; la masa atómica, número de masa, número atómico e isótopos.
Átomos y moléculas
Partículas subatómicas
Todo átomo está formado por dos partes, que son:
a) Núcleo atómico: corresponde a la zona central. En él se encuentra la mayor masa del átomo.
b) Corteza atómica: corresponde a la zona que rodea al núcleo. Es la parte más voluminosa del átomo.
-
Partículas sub-atómicas
¿Existe algo más? Sí. Tanto en el núcleo como en la corteza se ubican varias partículas muy pequeñas; son las llamadas partículas sub-atómicas.
Existen 3 tipos principales de partículas sub-atómicas:
a) Protones. Se caracterizan porque:
-
Están en el núcleo del átomo.
-
Tienen carga eléctrica positiva.
-
Se simbolizan P+.
-
Tienen una masa significativamente mayor que la de los electrones.
b) Neutrones. Se caracterizan porque:
-
Se encuentran en el núcleo del átomo.
-
No tienen carga eléctrica.
-
Se simbolizan n.
-
Tienen masa muy similar a la de los protones, aunque ligeramente mayor.
-
Son los responsables de mantener unidos los protones en el núcleo.
c) Electrones. Se caracterizan porque:
-
Se encuentran en la corteza del átomo.
-
Giran alrededor del núcleo a gran velocidad.
-
Tienen carga eléctrica negativa.
-
Se simbolizan
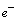 .
.
Su masa es muy pequeña en relación a la masa de las otras sub-partículas.
Cuadro resumen de las partículas subatómicas |
||||||
|
Carga eléctrica |
Masa |
Localización en el átomo |
símbolo |
||
|---|---|---|---|---|---|---|
Coulomb |
g |
u.m.a |
|
|||
Electrón |
-1.6 X 10-19 |
-1 |
9.1 X 10-28 |
0.00055 |
Se mueven alrededor del núcleo |
e- |
Protón |
1.6 X 10-19 |
+1 |
1.67 X 10-24 |
1.00727 |
En el núcleo |
p+ |
Neutrón |
0 |
0 |
1.67 X 10-24 |
1.00866 |
En el núcleo |
n0 |
![]()
Los átomos de los diferentes elementos tienen estructuras internas diferentes, pero los protones, neutrones y electrones de un átomo son iguales a los de cualquier otro. Los átomos de un elemento difieren de los de otro por el número de protones (número atómico).
Número atómico:
Al número de protones se le da el nombre de número atómico del elemento. Por ejemplo el hidrógeno tiene un número atómico igual a uno, por lo tanto su átomo neutro tendrá un protón, ocupando el núcleo y un electrón en torno a éste.
El número atómico se representa con la letra Z y da la identidad del átomo. Un átomo en su estado natural es neutro y tiene número igual electrones y protones. Un átomo de sodio tiene un número atómico 11, posee 11 protones y 11 electrones. Un átomo de magnesio Mg, tiene número atómico 12, posee 12 electrones y 12 protones, y un átomo de Uranio U, que tiene número atómico 92, posee 92 electrones y 92 protones y el orden en la tabla periódica esta de acuerdo a los números atómicos.
Número atômico = número de protones = número de electrones .
Cada elemento tiene un número atómico propio y éste se reporta en la tabla periódica.
Número de masa.
El número de masa es la suma de los protones y neutrones,, por lo que siempre es un número entero y no esta reportado en la tabla periódica, pero es posible determinarlo a partir de la masa atómica (número fraccionario que si esta reportado en la tabla), aproximando el valor de éste al número entero inmediato superior o inferior según sea el caso, por ejemplo:
Masa atómica del sodio = 22.9 |
Número de masa del sodio = 23
|
Masa atómica del aluminio = 26.98 |
Número de masa del aluminio = 27 |
De esta manera conociendo el número de masa de un átomo, así como su número atómico (número de p+ o número de e-), es posible calcular el número de neutrones que un átomo tiene en su núcleo.
Número de neutrones = número de masa – número atómico.
Sin embargo, para un mismo elemento se han encontrado átomos con diferente número de masa, pero con igual número atómico llamados isótopos.