Con este recurso se pretende hacer una breve descripción del modelo atómico de Bohr mediante la presentación de sus postulados y establecer las relaciones que tiene el mismo con la mecánica cuántica.
Átomos y moléculas
Modelo atómico de Bohr
El electrón puede promoverse a un nivel de energía superior pero para ello necesita "absorber" energía. Cuando vuelve a su nivel de energía original, el electrón necesita emitir la energía absorbida (por ejemplo en forma de radiación).El físico danés Niels Bohr ( Premio Nobel de Física 1922), postuló que los electrones giran a grandes velocidades alrededor del núcleo atómico. En ese caso, los electrones se disponen en diversas órbitas circulares, las cuales determinan diferentes niveles de energía
Para realizar su modelo atómico utilizó el átomo de hidrógeno. Describió el átomo de hidrógeno con un protón en el núcleo, y girando a su alrededor en una orbita circular lo más cercana posible un electrón.
El modelo atómico de Bohr para otros elementos se basa en tres postulados:
Postulados:
Primer Postulado:
Los electrones giran alrededor del núcleo en órbitas estacionarias sin emitir energía
Segundo Postulado:
Los electrones solo pueden girar alrededor del núcleo en aquellas órbitas para las cuales el momento angular del electrón es un múltiplo entero de h/2π.
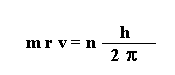
siendo "h" la constante de Planck, m la masa del electrón, v su velocidad, r el radio de la órbita y n un número entero (n=1, 2, 3, ...) llamado número cuántico principal, que vale 1 para la primera órbita, 2 para la segunda, etc.
Tercer postulado:
Cuando un electrón pasa de una órbita externa a una más interna, la diferencia de energía entre ambas órbitas se emite en forma de radiación electromagnética.
Mientras el electrón se mueve en cualquiera de esas órbitas no radia energía, sólo lo hace cuando cambia de órbita. Si pasa de una órbita externa (de mayor energía) a otra más interna (de menor energía) emite energía, y la absorbe cuando pasa de una órbita interna a otra más externa. Por tanto, la energía absorbida o emitida será:
![]()
En resumen podemos decir que los electrones se encuentran en diversas órbitas circulares que determinan diferentes niveles de energía.
Niveles de energía.
En un átomo, los electrones están girando alrededor del núcleo formando capas. En cada una de ellas, la energía que posee el electrón es distinta. En efecto; en las capas muy próximas al núcleo, la fuerza de atracción entre éste y los electrones es muy fuerte, por lo que estarán fuertemente ligados.
Ocurre lo contrario en las capas alejadas, en las que los electrones se encuentran débilmente ligados, por lo que resultará más fácil realizar intercambios electrónicos en las últimas capas.
El hecho pues, de que los electrones de un átomo tengan diferentes niveles de energía, nos lleva a clasificarlos por el nivel energético (o banda energética) en el que se encuentra cada uno de ellos. Las bandas que nos interesa a nosotros para entender mejor el comportamiento del átomo son:
La Banda de Valencia y la Banda de Conducción.
La Banda de Valencia es un nivel de energía en el que se realizan las combinaciones químicas. Los electrones situados en ella, pueden transferirse de un átomo a otro, formando iones que se atraerán debido a su diferente carga, o serán compartidos por varios átomos, formando moléculas.
El átomo de Sodio (Na) tiene 11 electrones, 2 en la primera capa, 8 en la segunda y 1 en la tercera, y el Cloro (Cl) tiene 17 electrones, 2 en la primera, 8 en la segunda y 7 en la tercera. Debido a que todos los átomos tienden a tener 8 electrones en la última capa (regla del octeto): el Sodio cederá 1 electrón al Cloro con lo que el primero se quedará con 8 electrones en su ahora última capa, en cambio el Cloro aceptará ese electrón pasando su última capa de tener 7 electrones a 8
Así pues. El átomo de Sodio que ha perdido un electrón se ha transformado en un ión positivo:
![]()
La Banda de conducción es un nivel de energía en el cual los electrones están aún más desligados del núcleo, de tal forma que, en cierto modo, todos los electrones (pertenecientes a esa banda) están compartidos por todos los átomos del sólido, y pueden desplazarse por este formando una nube electrónica. Cuando un electrón situado en la banda de valencia se le comunica exteriormente energía, bien sea eléctricamente, por temperatura, luz, étc. puede (al ganar energía) saltar a la banda de conducción, quedando en situación de poder desplazarse por el sólido. |