Con este recurso en particular se pretende mostrar la forma en que se llevan a cabo los enlaces entre los elementos que conforman el bloque de elementos representativos de la tabla periódica.
El enlace químico
Formación de enlaces en el bloque de los elementos representativos
Enlace significa unión, un enlace químico es la combinación de dos o más átomos que se han unido con el fin de alcanzar la estabilidad, es decir tratar de parecerse al gas noble más cercano, es decir, para la mayoría de los elementos tener ocho electrones en su último nivel.
¿Qué mantiene unidos a los Átomos?Un concepto básico en química es el estudio de cómo los átomos forman compuestos. La mayoría de los elementos que conocemos existen en la naturaleza formando agrupaciones de átomos iguales o de distintos tipos, enlazados entre sí.
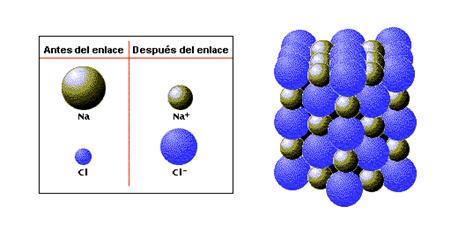
Tipos de Enlace Si los átomos enlazados son no metales e idénticos (como en El enlace covalente se forma cuando ambos átomos no poseen el número de electrones externos del gas noble más cercano. El átomo de cloro, por ejemplo, tiene un electrón menos que el átomo de argón (17 y 18 respectivamente). Cuando dos átomos de cloro forman un enlace covalente compartiendo dos electrones (uno de cada átomo), ambos consiguen el número 18 del argón (Cl : Cl). Es común representar un par de electrones compartido por medio de un guión entre los átomos individuales: Cl – Cl y la fórmula es Cl2. |