Formación de enlaces covalentes
A continuación desarrollaremos ejemplos con elementos que existen como moléculas diatómicas.
![]() , cloro molecular, formado por dos átomos de cloro. Como es un no metal, sus átomos se unen por enlaces covalentes.
, cloro molecular, formado por dos átomos de cloro. Como es un no metal, sus átomos se unen por enlaces covalentes.
El cloro es un elemento del grupo VII A. |
El átomo de cloro solo necesita un electrón para completar su octeto. Al unirse con otro átomo de cloro ambos comparten su electrón desapareado y se forma un enlace covalente sencillo entre ellos. Este enlace se representa mediante una línea entre los dos átomos.
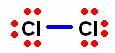
La línea representa un enlace covalente sencillo, formado por dos electrones. Estos electrones son compartidos por ambos átomos.
![]() . La molécula de oxigeno también es diatómica. Por ser del grupo VIA la estructura de Lewis del oxigeno es:
. La molécula de oxigeno también es diatómica. Por ser del grupo VIA la estructura de Lewis del oxigeno es:
Al oxigeno le hacen falta dos electrones para completar su octeto. Cada oxigeno dispone de 6 electrones, con los cuales ambos deben tener al final ocho electrones. Por lo tanto el total de electrones disponibles es:
2 x 6 e- = 12 e- menos dos que se ocupan para el enlace inicial restan 10.
Estos 10 e- se colocan por pares al azar entre los dos átomos.
Ahora revisamos cuantos electrones tiene cada átomo alrededor. Observamos que el átomo de oxigeno de la izquierda esta completo, mientras que el de la derecha tiene solo seis. Entonces uno de los pares que rodean al oxigeno de la izquierda, se coloca entre los dos átomos formándose un doble enlace, y de esa forma los dos quedan con 8 electrones.
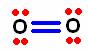
La molécula queda formada por un doble enlace covalente, 4 electrones de enlace y 4 pares de electrones no enlazados.
![]() El nitrógeno ubicado en el grupo VA, forma también una molécula diatómica, por lo que en su formación cada átomo de nitrógeno aporta 5 electrones x 2 átomos = 10 electrones, dos en enlace inicial quedan ocho electrones distribuidos en ambos átomos.
El nitrógeno ubicado en el grupo VA, forma también una molécula diatómica, por lo que en su formación cada átomo de nitrógeno aporta 5 electrones x 2 átomos = 10 electrones, dos en enlace inicial quedan ocho electrones distribuidos en ambos átomos.
En la anterior circunstancia, ambos átomos de nitrógeno están rodeados por solo 6 electrones, por lo tanto, cada uno de ellos debe compartir uno de sus pares con el otro átomo formándose un triple enlace.
La molécula queda formada por un enlace covalente triple, 6 electrones enlazados y dos pares de electrones no enlazados.
En los compuestos covalentes formados por 3 elementos o más, siempre debe seleccionarse un átomo central para hacer el esqueleto básico del compuesto. Para esto se siguen las siguientes reglas:
|
|
|
|
|
|