Con este recurso en particular se pretende mostrar las características de los diferentes tipos de enlace que se mencionaron anteriormente.
El enlace químico
Enlaces
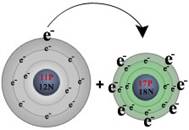
Enlace iónico Por ejemplo, durante la reacción del sodio con el cloro
Sodio (lado izquierdo) cede su único electrón de valencia al cloro (a la derecha), Resultando en:
Un ión sodio cargado positivamente (izquierda) y un ión de cloro cargado negativamente (ion cloruro)(derecha). |
Note que cuando el sodio pierde su electrón de valencia, se hace más pequeño, mientras que el cloro se hace más grande cuando gana un electrón adicional. Esto es típico de los tamaños relativos de iones a átomos. Después que la reacción tiene lugar, los iones cargado Na+ y Cl- se enlazan gracias a las fuerzas electroestáticas, formando así un enlace iónico. Los compuestos iónicos comparten muchas características en común
Características de los compuestos iónicos:
-
Están formados por metal + no metal
-
No forman moléculas , existen como un agregado de aniones (iones negativos) y cationes (iones positivos).
-
Los metales ceden electrones formando cationes, los no metales aceptan electrones formando aniones.
-
Son sólidos a temperatura ambiente, ninguno es un líquido o un gas.
-
En solución acuosa, son buenos conductores de la electricidad.
-
Tienen altos puntos de fusión y ebullición.
-
Son solubles en solventes polares como el agua
|
|
|
||
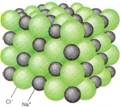
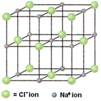
Disposición de los iones en un cristal de cloruro de sodio |
Modelo de esferas y varillas de un cristal de cloruro de sodio. El diámetro de un ion cloruro es alrededor del doble del de un ion de sodio |
El cloruro de sodio es un solidó cristalino de forma cúbica que tiene un punto de fusión de 808 ° C |
Formación de enlaces iónicos
Ejemplo: formación del NaF (Fluoruro de sodio)
|
|
ENLACE IONICO |
Si el sodio pierde el electrón de valencia, su ultimo nivel seria el 2, y en este tendría 8 electrones de valencia, formándose un catión (ion positivo) |
|
El fluor con 7 electrones de valencia, solo necesita uno para completar su octeto, si acepta el electrón que cede el sodio se forma un anión (ion negativo) |
|
La estructura de Lewis del compuesto se representa de la siguiente forma:
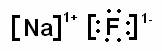
Enlace covalente
Otro tipo de enlace atómico ocurre cuando los átomos comparten electrones. Al contrario de los enlaces iónicos en los cuales ocurre una transferencia completa de electrones, el enlace covalente se, lleva a cabo cuando dos (o más) elementos no metálicos comparten electrones., esto ocurre ya que ninguno de los elementos que participan en el enlace podrá ganar o perder electrones, por lo cual compartirán electrones para poder completar su capa de valencia. Un buen ejemplo de un enlace covalente es el que ocurre entre dos átomos de hidrógeno. Los átomos de hidrógeno (H) tienen un electrón de valencia en su primera orbita. Puesto que la capacidad de esta orbita es de dos electrones, cada átomo hidrógeno tenderá a adquirir un segundo electrón. Para que el átomo de hidrógeno complete su capa de valencia reaccionará con un átomo de H presente para formar la molécula ![]() . Ya que la molécula de hidrógeno es una combinación de átomos iguales, los átomos compartirán cada uno de sus electrones individuales, formando así un enlace covalente. De esta manera, ambos átomos adquieren la estabilidad de su capa de valencia al adquirir la configuración del helio..
. Ya que la molécula de hidrógeno es una combinación de átomos iguales, los átomos compartirán cada uno de sus electrones individuales, formando así un enlace covalente. De esta manera, ambos átomos adquieren la estabilidad de su capa de valencia al adquirir la configuración del helio..
Características del enlace covalente:
-
Se caracterizan por la compartición de electrones. Los átomos no ganan ni pierden electrones, los comparten.
-
Esta formado por elementos no metálicos. Pueden ser 2 o más no metales.
-
Pueden estar unidos por enlaces sencillos, dobles o triples, dependiendo de los elementos que se enlazan.
Las características de los compuestos unidos por enlaces covalentes son:
-
Pueden presentarse en cualquier estado de la materia: sólido, líquido o gaseoso.
-
En general, son malos conductores del calor y la electricidad.
-
Tienen punto de fusión y ebullición relativamente bajos.
-
Son solubles en solventes no polares como benceno, tetracloruro de carbono, etc., e insolubles en solventes polares como el agua.
Formación de enlaces covalentes