El presente objeto de aprendizaje presenta una explicación acerca de los átomos que pueden quedar con el octeto incompleto, así como la explicación cuando no sucede así.
El enlace químico
Expansión y contracción del octeto
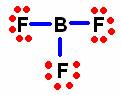
La regla del octeto sólo la cumplen totalmente los siguientes elementos carbono C, nitrógeno (N), oxígeno (O) y flúor (F). El resto de los elementos presentan excepciones en un gran número de compuestos, las cuales pueden ser explicadas considerando octetos incompletos (contracción) o una expansión de los mismos. Se considera un octeto incompleto cuando alrededor de un átomo, que forma parte de un compuesto, existe un número menor de 8 electrones. Por otro lado, cuando un átomo tiene a su alrededor más de 8 electrones se habla de una expansión del octeto. Ejemplos de octetos incompletos (contracción):
|
B |
b) Distribución simétrica del resto de los átomos:
F |
B |
F |
F |
c) Cuenta del número total de electrones de valencia:
Total = (3 átomos de flúor x 7 electrones de valencia) + (1 átomo de boro x 3 electrones de valencia).
Total = 21 + 3 = 24 electrones de valencia.
d) Estructura de Lewis con enlaces sencillos y octetos.
Ejemplo de expansión del octeto:
![]() (pentafluoruro de fosforo)
(pentafluoruro de fosforo)
a) Elección del átomo central
P |
b) Distribución simétrica del resto de los átomos
F |
||
F |
||
F |
P |
|
F |
||
F |
c) Cuenta el número total de electrones de valencia:
Total = (5 átomos de F x 7 electrones de valencia) + (1 átomo de P x 5 electrones de valencia)
Total = 35 + 5 = 40 electrones de valencia.
d) Estructura de Lewis con enlaces sencillos y octetos:
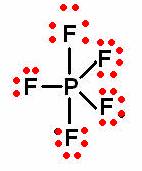
| Existen cinco enlaces P—F, es decir, 10 electrones alrededor del átomo central, por lo que se debe considerar que el fósforo en el |