El propósito de este objeto de aprendizaje es mostrar la teoría del octeto de Lewis (estructura), su descripción y la manera cómo se representa en las moléculas la estructura punto-electrón.
El enlace químico
Octeto de Lewis
En 1916, el químico americano Gilbert Newton Lewis propusó que los enlaces químicos se formaban entre los átomos porque los electrones externos de los átomos involucrados interactuaban . Lewis observó que muchos elementos eran más estables cuando contenían ocho electrones en su capa más externa y sugirió que los átomos con menos de ocho electrones se enlazaban para completar con ocho electrones sus capas más externas. El ultimo grupo de la tabla periódica VIII A (18), que forma la familia de los gases nobles, son los elementos mas estables de la tabla periódica. Esto se debe a que tienen 8 electrones en su capa más externa, excepto el Helio que tiene solo 2 electrones, que también se considera como una configuración estable. Los elementos al combinarse químicamente aceptan, ceden o comparten electrones para adquirir ocho electrones en su n ivel más externo. La aplicación de esta regla es muy importante para explicar el comportamiento químico de los gases nobles, ya que todos, con excepción del helio, poseen ocho electrones de valencia, razón por la cual tienen una tendencia prácticamente nula a formar enlaces químicos y, por consiguiente, para formar compuestos .En las estructuras de Lewis se representa a los átomos mediante los símbolos de los elementos y a los electrones mediante puntos colocados alrededor del símbolo. La colocación de los electrones se hace en cada uno de los lados de un cuadrado imaginario alrededor del símbolo (hasta un par por lado), iniciando con un electrón por lado, hasta completar el número total de electrones de valencia. |
Reglas para elaborar estructuras de Lewis
Ejemplos:
Estructura de Lewis del ion BF4¯.
B: 3 electrones de valencia.
F: 7 electrones de valencia.
Los átomos aportan: 3 + (4 x 7) = 31 electrones de valencia; la carga negativa del ion representa un electrón adicional. El número de electrones totales del ion BF4¯ es de 32, lo que implica que hay que acomodar 16 pares de electrones alrededor de 5 átomos. La estructura de Lewis del ion es:
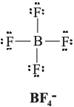
Estructura de Lewis de la molécula de ![]() :
:
C: 4 electrones de valencia.
O: 6 electrones de valencia.
| Nº electrones de valencia: 4 + (6 x 2) = 16, lo que implica que hay que acomodar 8 pares de electrones alrededor de 3 átomos. La estructura de Lewis de esta molécula es: |
